34 câu trắc nghiệm Hóa 10 Kết nối tri thức Bài 8: Định luật bảo toàn. Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học có đáp án
29 câu hỏi
Phosphorus được dùng vào mục đích quân sự như sản xuất bom, đạn cháy, đạn khói. Nguyên tố phosphorus ở ô số 15, chu kì 3, nhóm VA trong bảng tuần hoàn. Hãy cho biết:
a) Cấu hình electron của phosphorus.
b) Số electron lớp ngoài cùng của nguyên tử phosphorus.
c) Phosphorus là kim loại hay phi kim.
d) Công thức oxide cao nhất của phosphorus.
e) Công thức hợp chất khí của phosphorus với hydrogen.
f) Công thức hydroxide cao nhất của phosphorus.
g) Oxide và hydroxide cao nhất của phosphorus có tính acid hay base.
Nguyên tử của một nguyên tố có cấu hình electron: [Ar]4s2. Nguyên tố này là một trong những nguyên tố thiết yếu cho cơ thể, được bổ sung trong các sản phẩm sữa. Hãy xác định vị trí nguyên tố này trong bảng tuần hoàn và cho biết tính chất của nó.
Nguyên tố magnesium thuộc ô số 12, chu kì 3, nhóm IIA của bảng tuần hoàn.
a) Viết cấu hình electron của magnesium, nêu một số tính chất cơ bản của đơn chất và oxide, hydroxide chứa magnesium.
b) So sánh tính kim loại của magnesium với các nguyên tố lân cận trong bảng tuần hoàn.
Potassium là nguyên tố dinh dưỡng thiết yếu cho thực vật và con người. Nguyên tử potassium có cấu hình electron lớp ngoài cùng là 4s1.
a) Nêu vị trí của potassium trong bảng tuần hoàn.
b) Nêu một số tính chất cơ bản của đơn chất và hợp chất chứa potassium.
Nguyên tố X có Z = 38, có cấu hình electron lớp ngoài cùng và sát ngoài cùng là 4s24p65s2.
a) Cho biết vị trí của X trong bảng tuần hoàn.
b) Hãy cho biết tính chất hóa học cơ bản của X là gì?
c) Viết công thức oxide và hydroxide cao nhất của X.
d) Viết PTHH của phản ứng xảy ra khi cho X tác dụng với Cl2.
Nguyên tố X nằm ở chu kì 4, nhóm VIIA của bảng tuần hoàn.
a) Viết cấu hình electron nguyên tử của X.
b) Nguyên tử X có bao nhiêu electron thuộc lớp ngoài cùng?
c) Electron lớp ngoài cùng thuộc những phân lớp nào?
d) X là kim loại hay phi kim?
Hydroxide của nguyên tố T có tính base rất mạnh và tác dụng được với HCl theo tỉ lệ mol giữa hydroxide của T và HCl là 1: 2. Hãy dự đoán nguyên tố T thuộc nhóm nào trong bảng tuần hoàn các nguyên tố hóa học.
Oxide cao nhất của hai nguyên tố X và Y khi tan trong nước tạo dung dịch làm giấy quỳ tím chuyển sang màu xanh. Biết rằng tỉ lệ nguyên tử X cũng như Y với oxygen trong các oxide cao nhất là bằng nhau, khối lượng phân tử oxide cao nhất của Y lớn hơn oxide cao nhất của X.
a) Dự đoán X và Y thuộc loại nguyên tố nào (kim loại, phi kim,…). Giải thích?
b) Dự đoán hai nguyên tố X và Y thuộc cùng một chu kì hay cùng một nhóm? Giải thích?
c) So sánh số hiệu nguyên tử của X và Y. Giải thích?
Borax (Na2B4O7.10H2O), còn gọi là hàn the, là khoáng chất dạng tinh thể. Nhờ có khả năng hòa tan oxide của kim loại, borax được dung để làm sạch bề mặt kim loại trước khi hàn, chế tạo thủy tinh quang học, men đồ sứ,… Một lượng lớn borax được dung để sản xuất bột giặt.
a) Nêu vị trí trong bảng tuần hoàn của mỗi nguyên tố có trong thành phần của borax và viết cấu hình electron của nguyên tử các nguyên tố đó.
b) Sắp xếp các nguyên tố trên theo chiều bán kính nguyên tử tăng dần.
c) Sắp xếp các nguyên tố trên theo chiều độ âm điện giảm dần.
Giải thích dựa vào quy luật biến thiên trong bảng tuần hoàn.
Công thức cấu tạo của phân tử cafein, một chất gây đắng tìm thấy nhiều trong café và trà được biểu diễn ở hình bên.
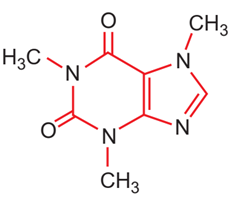
a) Nêu vị trí của các nguyên tố tạo nên cafein trong bảng tuần hoàn.
b) So sánh tính phi kim, bán kính nguyên tử và độ âm điện của các nguyên tố đó và giải thích.
Các nguyên tố X, Y, T, Q có số hiệu nguyên tử lần lượt là 5, 11, 13, 19.
a) Viết cấu hình electron của chúng và xác định vị trí mỗi nguyên tố trong bảng tuần hoàn.
b) Xếp các nguyên tố trên theo thứ tự tính kim loại tăng dần. Giải thích.
Các nguyên tố A, D, E, G có số hiệu nguyên tử lần lượt là 6, 9, 14, 17.
a) Viết cấu hình electron của chúng và xác định vị trí mỗi nguyên tố trong bảng tuần hoàn.
b) Xếp các nguyên tố trên theo thứ tự tính phi kim giảm dần (biết độ âm điện của G lớn hơn A). Giải thích.
Cấu hình electron theo lớp của năm nguyên tố X, Q, Z, A, D như sau:
X: 2, 2; Q: 2, 8, 8, 2;
Z: 2, 7; A: 2, 8, 8, 7; D: 2.
a) Nêu vị trí mỗi nguyên tố trong bảng tuần hoàn.
b) Xác định kim loại mạnh nhất, phi kim mạnh nhất, nguyên tố kém hoạt động nhất trong số chúng. Giải thích.
Ion M3+ có phân lớp electron ngoài cùng là 3d5. Ion Y– có cấu hình electron ngoài cùng là 4p6.
a) Xác định cấu hình electron của nguyên tử M và nguyên tử Y.
b) Xác định vị trí của M, Y trong bảng tuần hoàn.
Các nguyên tố trong bảng tuần hoàn được sắp xếp theo chiều tăng dần
khối lượng nguyên tử.
bán kính nguyên tử.
số hiệu nguyên tử.
độ âm điện của nguyên tử.
Nguyên tố X ở chu kì 3, nhóm IIA của bảng tuần hoàn. Cấu hình electron của nguyên tử nguyên tố X là
1s22s22p6.
1s22s22p63s23p1.
1s22s22p63s3.
1s22s22p63s2.
Chromium (Cr) được sử dụng nhiều trong luyện kim để chế tạo hợp kim chống ăn mòn và đánh bóng bề mặt. Nguyên tử chromium có cấu hình electron viết gọn là [Ar]3d54s1. Vị trí của
Cr trong bảng tuần hoàn là
ô số 17, chu kì 4, nhóm IA.
ô số 24, chu kì 4, nhóm VIB.
ô số 24, chu kì 3, nhóm VIB.
ô số 27, chu kì 4, nhóm VIB.
Cho cấu hình electron nguyên tử của các nguyên tố sau: X (1s22s22p63s1); Y (1s22s22p63s2) và Z (1s22s22p63s23p1). Dãy các nguyên tố xếp theo chiều tăng dần tính kim loại từ trái sang phải là
Z, Y, X.
X, Y, Z.
Y, Z, X.
Z, X, Y.
Anion X2– có cấu hình electron [Ne]3s23p6 . Nguyên tố X có tính chất nào sau đây?
Kim loại.
Phi kim
Trơ của khí hiếm.
Lưỡng tính.
X, Y và Z là các nguyên tố thuộc cùng một chu kì của bảng tuần hoàn. Oxide của X tan trong nước tạo thành dung dịch làm hồng giấy quỳ tím. Oxide của Y phản ứng với nước tạo thành dung dịch làm xanh giấy quỳ tím. Oxide của Z phản ứng được với cả acid và base. Cách phân loại X, Y, Z nào sau đây là đúng?
X là kim loại; Y là chất lưỡng tính; Z là phi kim.
X là phi kim; Y là chất lưỡng tính; Z là kim loại.
X là kim loại; Z là chất lưỡng tính; Y là phi kim.
X là phi kim; Z là chất lưỡng tính; Y là kim loại.
Cấu hình electron nguyên tử iron (Fe): [Ar]3d64s2. Vị trí iron (Fe) trong bảng tuần hoàn là
ô 26, chu kì 4, nhóm VIIIA.
ô 26, chu kì 4, nhóm VIIIB.
ô 26, chu kì 4, nhóm IIA.
ô 26, chu kì 4, nhóm IIB.
Nguyên tố X có số hiệu nguyên tử là 8. Nguyên tử của nguyên tố X có cấu hình electron là
1s22s22p3.
1s22s12p5.
1s12s22p5.
1s22s22p4.
Nguyên tố X thuộc chu kì 3, nhóm IIA. Nguyên tử của nguyên tố X có cấu hình electron là
1s22s22p63s1.
1s22s22p6.
1s22s22p53s4.
1s22s22p63s2.
Nguyên tố X có số hiệu nguyên tử là 8. Nguyên tố X thuộc chu kì
1.
2.
3.
4.
Nguyên tố X có số hiệu nguyên tử là 8. Nguyên tố X thuộc nhóm
VIIIB.
VIB.
VIIA.
VIA.
Nguyên tử của nguyên tố X có cấu hình electron: 1s22s22p63s23p3 . X thuộc chu kì
1.
2.
3.
4.
Nguyên tử của nguyên tố X có cấu hình electron: 1s22s22p63s23p3. Số electron lớp ngoài cùng của X là
1.
2.
6.
5.
Nguyên tử của nguyên tố X có cấu hình electron: 1s22s22p63s23p3. X thuộc nhóm
IA.
VA.
IIIA.
IVA
Thứ tự tăng dần bán kính nguyên tử là
Li, Be, F, Cl.
Be, Li, F, Cl.
F, Be, Li, Cl.
Cl, F, Li, Be.




