30 câu hỏi
Khi tác dụng với hydrochloric acid, ammonia đóng vai trò là
acid.
base.
chất oxi hoá.
chất khử.
Khi cho giấy quỳ tím tẩm ướt vào bình đựng khí NH3 thì giấy quỳ tím chuyển sang màu
đỏ.
xanh.
vàng.
nâu.
Ở trạng thái lỏng nguyên chất, phân tử chất nào sau đây tạo được liên kết hydrogen với nhau?
Nitrogen.
Ammonia.
Oxygen.
Hydrogen.
Trong nước, phân tử/ion nào sau đây thể hiện vai trò là acid theo thuyết Bronsted - Lowry?
\({\rm{N}}{{\rm{H}}_3}\).
\({\rm{NH}}_4^ + \).
\({\rm{NO}}_3^ - \).
\({{\rm{N}}_2}\).
Trong phương pháp Ostwald, ammonia bị oxi hoá bởi oxygen không khí tạo thành sản phẩm chính là
NO.
\({{\rm{N}}_2}\).
\({{\rm{N}}_2}{\rm{O}}\).
\({\rm{N}}{{\rm{O}}_2}\).
Cho dung dịch \({\rm{N}}{{\rm{H}}_3}\) vào dung dịch chất nào sau đây thu được kết tủa trắng?
\({\rm{HCl}}\).
\({{\rm{H}}_2}{\rm{S}}{{\rm{O}}_4}\).
\({{\rm{H}}_3}{\rm{P}}{{\rm{O}}_4}\).
\({\rm{AlC}}{{\rm{l}}_3}\).
Cho vài giọt dung dịch phenolphthalein vào dung dịch NH3, phenolphthalein chuyển sang màu nào sau đây?
Hồng.
Xanh.
Không màu.
Vàng.
Nhiệt phân hoàn toàn muối nào sau đây thu được sản phẩm chỉ gồm khí và hơi?
\({\rm{NaCl}}\).
\({\rm{CaC}}{{\rm{O}}_3}\).
\({\rm{KCl}}{{\rm{O}}_3}\).
\({\left( {{\rm{N}}{{\rm{H}}_4}} \right)_2}{\rm{C}}{{\rm{O}}_3}\).
Phân biệt được đung dịch \({\rm{N}}{{\rm{H}}_4}{\rm{Cl}}\) và \({\rm{NaCl}}\) bằng thuốc thử là dung dịch
\({\rm{KCl}}\).
\({\rm{KN}}{{\rm{O}}_3}\).
\({\rm{KOH}}\).
\({{\rm{K}}_2}{\rm{S}}{{\rm{O}}_4}\).
Chất có thể dùng để làm khô khí NH3 là
H2SO4 đặc.
P2O5.
CuSO4 khan.
KOH rắn.
Nhận định nào sau đây về phân tử ammonia không đúng?
Phân cực mạnh.
Có một cặp electron không liên kết.
Có độ bền nhiệt rất cao.
Có khả năng nhận proton.
Tính base của NH3 do:
trên N còn cặp e tự do.
phân tử có 3 liên kết cộng hóa trị phân cực.
NH3 tan được nhiều trong nước.
NH3 tác dụng với nước tạo NH4OH.
Trong các phản ứng dưới đây, phản ứng nào NH3 thể hiện tínhbase?
8NH3 + 3Cl2 6NH4Cl+N2.
4NH3 + 5O2 4NO +6H2O.
2NH3 + 3CuO 3Cu + N2+3H2O.
NH3 + CO2 + H2O NH4HCO3.
Cho phản ứng: 2NH3 + 3Cl2 6HCl +N2. Kết luận nào sau đây đúng?
NH3 làchấtkhử.
NH3 là chất oxihoá.
Cl2 vừa oxi hoávừakhử.
Cl2 là chấtkhử.
Phản ứng nhiệt phân nào dưới đây không đúng?
NH4ClNH3 + HCl.
NH4HCO3 NH3 + H2O + CO2.
NH4NO3 NH3 + HNO3.
NH4NO2 N2 + 2H2O.
Cho từ từ dung dịch (NH4)2SO4 vào dung dịch Ba(OH)2. Hiện tượng xảy ra là
có kết tủa trắng.
không có hiện tượng.
có khí mùi khai bay lên và có kết tủa trắng.
có khí mùi khai bay lên.
Trong phân tử NH4NO3, nitrogen có số oxi hoá là
+1.
-1; +3.
+2.
-3; +5.
Liên kết trong phân tử NH3 là liên kết:
cộng hóa trị có cực.
ion.
kim loại.
cộng hóa trị không cực.
Xét cân bằng hoá học:
.
Cân bằng sẽ chuyển dịch theo chiều thuận khi cho thêm vài giọt dung dịch nào sau đây?
\({\rm{N}}{{\rm{H}}_4}{\rm{Cl}}\).
\({\rm{NaOH}}\).
\({\rm{HCl}}\).
\({\rm{NaCl}}\).
Xét cân bằng hoá học:
Hằng số cân bằng \(\left( {{{\rm{K}}_{\rm{C}}}} \right)\) của phản ứng được biểu diễn bằng biểu thức nào sau đây?
\({{\rm{K}}_{\rm{C}}} = \frac{{\left[ {{\rm{NH}}_4^ + } \right]\left[ {{\rm{O}}{{\rm{H}}^ - }} \right]}}{{\left[ {{\rm{N}}{{\rm{H}}_3}} \right]}}\).
\({{\rm{K}}_{\rm{C}}} = \frac{{\left[ {{\rm{NH}}_4^ + } \right]\left[ {{\rm{O}}{{\rm{H}}^ - }} \right]}}{{\left[ {{\rm{N}}{{\rm{H}}_3}} \right]\left[ {{{\rm{H}}_2}{\rm{O}}} \right]}}\).
\({{\rm{K}}_{\rm{C}}} = \frac{{\left[ {{\rm{NH}}_4^ + } \right]\left[ {{\rm{O}}{{\rm{H}}^ - }} \right]}}{{\left[ {{{\rm{H}}_2}{\rm{O}}} \right]}}\).
\({{\rm{K}}_{\rm{C}}} = \frac{{\left[ {{\rm{NH}}_4^ + } \right]}}{{\left[ {{\rm{N}}{{\rm{H}}_3}} \right]}}\).
Cho phương trình:
N2(g) + 3H2(g) 2NH3 (g)
Khi tăng nồng độ của hydrogenlên2lần, tốc độ phản ứng thuận:
giảmđi 2 lần.
tăng lên2lần.
tănglên8lần.
tănglên6lần.
X là muối khi tác dụng với dung dịch NaOH dư sinh khí mùi khai, tác dụng với dung dịch BaCl2 sinh kết tủa trắng không tan trong HNO3. X là muối nào trong số các muối sau?
(NH4)2CO3.
(NH4)2SO3.
NH4HSO3.
(NH4)2SO4.
Để phân biệt muối ammonium với các muối khác, người ta cho nó tác dụng với kiềm mạnh, vì khi đó:
thoát ra một chất khí không màu, ít tan trong nước.
thoát ra một chất khí không màu, có mùi khai, làm xanh giấy quỳ tím ẩm.
thoát ra một chất khí màu nâu đỏ, làm xanh giấu quỳ tím ẩm.
thoát ra chất khí không màu, không mùi, tan tốt trong nước.
Cho các phát biểu sau:
(1) Các muối ammoniumtan trong nước tạo dung dịch chất điện limạnh;
(2) Ion NH4+tácdụngvớidungdịchacidtạokếttủamàutrắng;
(3) Muốiammoniumtácdụngvớidungdịchbasethuđượckhícómùikhai;
(4) Hầu hết muối ammoniumđều bền nhiệt.
Phát biểu đúnglà
(1)và(3).
(1)và(2).
(2)và(4).
(2) và(3).
Nhận định nào sau đây không đúng?
Ammonia là khí không màu, không mùi, tan nhiều trong nước.
Ammonia là một base.
Đốt cháy NH3 không có xúc tác thu được N2 và H2O.
Phản ứng tổng hợp NH3 từ N2 và H2 là phản ứng thuận nghịch.
Cho phương trình hóa học tổng hợp NH3:
N2(g) + 3H2(g) 2NH3 (g);
Hiệu suất phản ứng tổng hợp NH3 tăng nếu:
Giảm áp suất, tăng nhiệt độ, có xúc tác.
Giảm áp suất, giảm nhiệt độ, có xúc tác.
Tăng áp suất, giảm nhiệt độ, có xúc tác.
Tăng áp suất, tăng nhiệt độ, có xúc tác.
Phân tử ammonia và ion ammonium đều:
(1) chứa liên kết cộng hoá trị;
(2) là base theo thuyết Brønsted – Lowry;
(3) là acid theo thuyết Brønsted – Lowry;
(4) chứa nguyên tử \({\rm{N}}\) có số oxi hoá là -3.
Số nhận định đúng là
2.
1.
4.
3.
Các chất khí được thu vào bình theo đúng nguyên tắc bằng cách đẩy không khí \(\left( {X,Y,Z} \right)\) và đẩy nước \(\left( T \right)\) như sau:
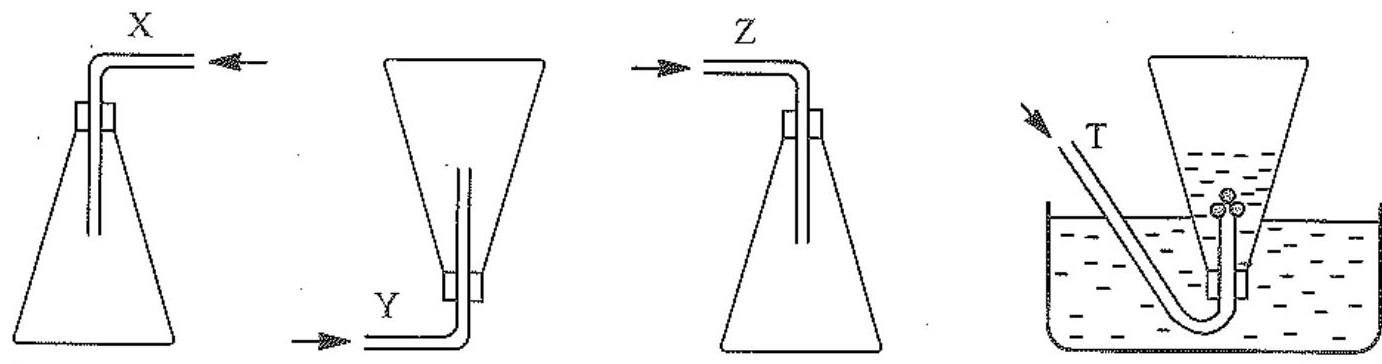
Nhận xét nào sau đây không đúng?
X là chlorine.
Y là hydrogen.
Z là nitrogen dioxide.
T là ammonia.
Xét cân bằng hoá học:
.
Hiệu suất phản ứng khi hệ đạt cân bằng ở áp suất 200 bar và 300 bar lần lượt bằng \({\rm{x\% }}\) và \({\rm{y\% }}\). Mối quan hệ giữa \({\rm{x}}\) và \({\rm{y}}\) là
\(5{\rm{x}} = 4{\rm{y}}\).
\(x = y\).
\(x > y\).
\(x < y\).
Nhận xét nào sau đây không đúng về muối ammonium?
Muối ammonium bền với nhiệt.
Các muối ammonium đều là chất điện li mạnh.
Tất cả các muối ammonium đều tan trong nước.
Các muối ammonium đều bị thủy phân trong nước.
