24 câu trắc nghiệm Hóa 10 Kết nối tri thức Bài 20: Ôn tập chương 6 (Đúng sai - Trả lời ngắn) có đáp án
39 câu hỏi
Tốc độ của một phản ứng hóa học
chỉ phụ thuộc vào nồng độ các chất tham gia phản ứng.
tăng khi nhiệt độ phản ứng tăng.
càng nhanh khi giá trị năng lượng hoạt hóa càng lớn.
Phản ứng 3H2 + N2 ![]() 2NH3 có tốc độ mất đi của H2 so với tốc độ hình thành NH3 như thế nào?
2NH3 có tốc độ mất đi của H2 so với tốc độ hình thành NH3 như thế nào?
Bằng 1/2.
Bằng 3/2.
Bằng 2/3.
Bằng 1/3.
Từ một miếng đá vôi và một lọ đựng dung dịch acid HCl 1M, thí nghiệm được tiến hành trong điều kiện nào sau đây sẽ thu được một lượng CO2 lớn nhất trong một khoảng thời gian xác định?
Tán nhỏ miếng đá vôi, cho vào dung dịch HC 1M, không đun nóng.
Tán nhỏ miếng đá vôi, cho vào dung dịch HCl 1M, đun nóng.
Cho miếng đá vôi vào dung dịch HCl 1M, không đun nóng.
Cho miếng đá vôi vào dung dịch HCl 1M, đun nóng.
Phương trình tổng hợp ammonia (NH3): N2(g) + 3H2(g) ![]() 2NH3(g). Nếu tốc độ tạo thành NH3 là 0,345 M/s thì tốc độ của chất phản ứng H2 là
2NH3(g). Nếu tốc độ tạo thành NH3 là 0,345 M/s thì tốc độ của chất phản ứng H2 là
0,345 M/s.
0,690 M/s.
0,173 M/s.
0,518 M/s.
Cho phản ứng đơn giản: 2A + B ![]() sản phẩm. Khi tăng nồng độ chất A lên gấp đôi, tốc độ phản ứng thay đổi như thế nào?
sản phẩm. Khi tăng nồng độ chất A lên gấp đôi, tốc độ phản ứng thay đổi như thế nào?
Tăng 2 lần.
Tăng 6 lần.
Tăng 4 lần.
Không đổi.
Khi tăng nồng độ chất tham gia, thì
tốc độ phản ứng tăng.
tốc độ phản ứng giảm.
không ảnh hưởng đến tốc độ phản ứng.
có thể tăng hoặc giảm tốc độ phản ứng.
Xét phản ứng S2O82– + 3I– ![]() 2SO42– + I3–. Tốc độ trung bình của sự mất đi của S2O82– tương đương với biểu thức nào sau đây?
2SO42– + I3–. Tốc độ trung bình của sự mất đi của S2O82– tương đương với biểu thức nào sau đây?
A. ![]() .
.
![]()
C. 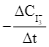 .
.
D. 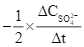 .
.
Đối với các phản ứng có chất khí tham gia, khi tăng áp suất, tốc độ phản ứng tăng là do
nồng độ của các chất khí tăng lên.
nồng độ của các chất khí giảm xuống.
chuyển động của các chất khí tăng lên.
nồng độ của các chất khí không thay đổi.
Cho phản ứng hóa học sau: C(s) + O2(g) ![]() CO2(g). Yếu tố nào sau đây không ảnh hưởng đến tốc độ phản ứng trên?
CO2(g). Yếu tố nào sau đây không ảnh hưởng đến tốc độ phản ứng trên?
Nhiệt độ.
Áp suất O2.
Hàm lượng carbon.
Diện tích bề mặt carbon.
Phát biểu nào sau đây không đúng?
Nhiên liệu cháy ở trên vùng cao nhanh hơn khi cháy ở vùng thấp.
Thực phẩm được bảo quản ở nhiệt độ thấp hơn sẽ giữ được lâu hơn.
Dùng men làm chất xúc tác để chuyển hóa cơm nếp thành rượu.
Nếu không cho nước dưa chua khi muối dưa thì dưa vẫn sẽ chua nhưng chậm hơn.
Cho phản ứng hóa học xảy ra trong pha khí sau: N2 + 3H2 ![]() 2NH3
2NH3
Phát biểu nào sau đây không đúng? Khi nhiệt độ phản ứng tăng lên,
tốc độ chuyển động của phân tử chất đầu (N2, H2) tăng lên.
tốc độ va chạm giữa phân tử N2 và H2 tăng lên.
số va chạm hiệu quả tăng lên.
tốc độ chuyển động của phân tử chất sản phẩm (NH3) giảm.
Phát biểu nào sau đây là đúng về xúc tác?
Xúc tác giúp làm tăng năng lượng hoạt hóa của phản ứng.
Khối lượng xúc tác không thay đổi sau phản ứng
Xúc tác không tương tác với các chất trong quá trình phản ứng.
Xúc tác kết hợp với sản phẩm phản ứng tạo thành hợp chất bền.
Cho các phát biểu sau:
(a) Phản ứng đơn giản là phản ứng xảy ra theo một bước.
(b) Phản ứng đơn giản là phản ứng có các hệ số tỉ lượng trong phương trình hóa học bằng nhau và bằng 1.
(c) Tốc độ của một phản ứng đơn giản tuân theo định luật tác dụng khối lượng.
(d) Hằng số tốc độ phản ứng là tốc độ của phản ứng khi nồng độ của tất cả các chất trong hỗn hợp phản ứng đều bằng nhau và bằng 1.
(e) Tốc độ của mọi phản ứng hóa học đều tuân theo định luật tác dụng khối lượng
(g) Hằng số tốc độ của phản ứng phụ thuộc vào thời gian.
(h) Hằng số tốc độ phản ứng là tốc độ của phản ứng khi nồng độ các chất phản ứng bằng nhau và bằng 1 M.
Số phát biểu không đúng là
5.
2.
3.
4.
Cho phản ứng: Br2 + HCOOH ![]() 2HBr + CO2. Nồng độ ban đầu của Br2 là a mol/L, sau 50 giây nồng độ Br2 còn lại là 0,01 mol/L. Tốc độ trung bình của phản ứng trên tính theo Br2 là 4.10–5 mol/(L.s). Giá trị của a là
2HBr + CO2. Nồng độ ban đầu của Br2 là a mol/L, sau 50 giây nồng độ Br2 còn lại là 0,01 mol/L. Tốc độ trung bình của phản ứng trên tính theo Br2 là 4.10–5 mol/(L.s). Giá trị của a là
0,012.
0,016.
0,014.
0,018.
Xét phản ứng phân hủy N2O5 trong dung môi CCl4 ở 450C:
N2O5(g) ![]() N2O4(g) + ½O2(g)
N2O4(g) + ½O2(g)
Ban đầu nồng độ của N2O5 là 2,33 M, sau 184 giây nồng độ của N2O5 là 2,08 M. Tốc độ trung bình của phản ứng tính theo N2O5 là
2,72.10-3 mol/(L.s).
1,36.10-3 mol/(L.s).
6,80.10-3 mol/(L.s).
6,80.10-4 mol/(L.s).
Cho phương trình hóa học của phản ứng: X + 2Y ![]() Z + T. Ở thời điểm ban đầu, nồng độ của chất X là 0,01 mol/L. Sau 20 giây, nồng độ của chất X là 0,008 mol/L. Tốc độ trung bình của phản ứng tính theo chất X trong khoảng thời gian trên là
Z + T. Ở thời điểm ban đầu, nồng độ của chất X là 0,01 mol/L. Sau 20 giây, nồng độ của chất X là 0,008 mol/L. Tốc độ trung bình của phản ứng tính theo chất X trong khoảng thời gian trên là
4,0.10−4mol/(L.s).
1,0.10−4mol/(L.s).
7,5.10−4 mol/(L.s).
5,0.10−4 mol/(L.s).
Cho phản ứng đơn giản: H2 + I2 ![]() 2HI
2HI
Người ta thực hiện ba thí nghiệm với nồng độ các chất đầu (![]() và
và ![]() ) được lấy khác nhau và xác định được tốc độ tạo thành HI trong 20 giây đầu tiên, kết quả cho trong bảng sau:
) được lấy khác nhau và xác định được tốc độ tạo thành HI trong 20 giây đầu tiên, kết quả cho trong bảng sau:
|
|
|
0,10 | 0,20 | 5,00 |
0,20 | 0,20 | 10,00 |
0,10 | 0,15 | 3,75 |
Biểu thức định luật tác dụng khối lượng viết cho phản ứng trên là
A. ![]() .
.
B. ![]() .
.
C. ![]() .
.
D. ![]() .
.
a. Tốc độ của phản ứng hóa học chỉ có thể được xác định theo sự thay đổi nồng độ chất phản ứng theo thời gian.
b. Tốc độ của phản ứng hóa học không thể xác định được từ sự thay đổi nồng độ chất sản phẩm tạo thành theo thời gian.
c. Dấu “–” trong biểu thức tính tốc độ trung bình theo biến thiên nồng độ chất phản ứng là để đảm bảo cho giá trị của tốc độ phản ứng không âm.
d. Tốc độ trung bình của một phản ứng trong một khoảng thời gian nhất định được biểu thị bằng biến thiên nồng độ một chất phản ứng hoặc sản phẩm tạo thành chia cho khoảng thời gian đó.
a. Phản ứng trong bình tam giác (1) có tốc độ thoát khí nhanh hơn.
b. Đá vôi dạng viên có tổng diện tích bề mặt nhỏ hơn đá vôi dạng đập nhỏ.
c. Nếu lấy cùng một lượng đá vôi thì đá vôi dạng đập nhỏ tan nhanh hơn đá vôi dạng viên.
d. Khi tăng diện tích bề mặt tiếp xúc, số va chạm giữa các chất đầu tăng lên, số va chạm hiệu quả cũng tăng theo, dẫn đến tốc độ phản ứng tăng.
a. Xúc tác V2O5 sẽ dần chuyển hoá thành chất khác nhưng khối lượng của V2O5 không thay đổi.
b. Khi giảm nhiệt độ của phản ứng thì tốc độ phản ứng giảm xuống.
c. Trong quá trình phản ứng thì nồng độ SO2 tăng còn nồng độ SO3 giảm dần.
d. Khi tăng áp suất khí SO2 hoặc O2 thì tốc độ phản ứng đều tăng.
a. Theo thời gian, nồng độ H2O2 giảm dần nên tốc độ phản ứng giảm dần.
b. Biểu thức tốc độ phản ứng: ![]() .
.
c. Tốc độ phản ứng tăng lên 2 lần khi nồng độ H2O2 tăng lên 2 lần.
d. Tốc độ phản ứng giảm xuống 3 lần khi nồng độ O2 tăng lên 9 lần và giữ nguyên nồng độ của H2O.
Cho các phản ứng hóa học sau:
(a) Fe3O4(s) + 4CO(g) ![]() 3Fe(s) + 4CO2(g)
3Fe(s) + 4CO2(g)
(b) 2NO2(g) ![]() N2O4(g)
N2O4(g)
(c) H2(g) + Cl2(g) ![]() 2HCl(g)
2HCl(g)
(d) CaO(s) + SiO2(s) ![]() CaSiO3(s)
CaSiO3(s)
(e) CaO(s) + CO2(g) ![]() CaCO3(s)
CaCO3(s)
(g) 2KI(aq) + H2O(aq) ![]() I2(s) + 2KOH(aq)
I2(s) + 2KOH(aq)
Có bao nhiêu phản ứng thay đổi tốc độ khi áp suất thay đổi?
Phản ứng tạo NO từ NH3 là một giai đoạn trung gian trong quá trình sản xuất nitric acid:
4NH3(g) + 5O2(g) ![]() 4NO(g) + 6H2O(g)
4NO(g) + 6H2O(g)
Có các biện pháp sau: (1) Tăng áp suất; (2) Giảm nồng độ các chất tham gia phản ứng; (3) Tăng nhiệt độ; (4) Sử dụng chất xúc tác Pt.
Liệt kê các biện pháp làm tăng tốc độ phản ứng theo dãy số thứ tự tăng dần.
Cho các trường hợp sau:
(a) Than củi đang cháy, dùng quạt thổi thêm không khí vào, sự cháy diễn ra mạnh hơn.
(b) Phản ứng oxi hoá SO2 thành SO3 diễn ra nhanh hơn khi có mặt của V2O5.
(c) Aluminium dạng bột phản ứng với dung dịch hydrochloric acid nhanh hơn so với aluminium dạng lá.
(d) Để thực phẩm trong tủ lạnh giúp cho thực phẩm được tươi lâu hơn.
(e) Sử dụng nồi áp suất để hầm thức ăn giúp thức ăn nhanh chín.
(g) Sử dụng các loại men thích hợp để làm sữa chua, lên men rượu, giấm,…
Tổng số trường hợp bị ảnh hưởng bởi nhiệt độ và chất xúc tác là bao nhiêu?
Xét phản ứng sau: 2ClO2 + 2NaOH
 NaClO3 + NaClO2 + H2O
NaClO3 + NaClO2 + H2O
Tốc độ phản ứng được viết như sau: ![]() . Thực hiện phản ứng với những nồng độ chất đầu khác nhau và đo tốc độ phản ứng tương ứng thu được kết quả trong bảng sau:
. Thực hiện phản ứng với những nồng độ chất đầu khác nhau và đo tốc độ phản ứng tương ứng thu được kết quả trong bảng sau:
TT | Nồng độ ClO2 (M) | Nồng độ NaOH (M) | Tốc độ phản ứng (mol/(L.s)) |
1 | 0,01 | 0,01 | 2.10–4 |
2 | 0,02 | 0,01 | 8.10–4 |
3 | 0,01 | 0,02 | 4.10–4 |
Tổng giá trị (x + y) là bao nhiêu?
Phosgen (COCl2) là một chất độc hóa học được sử dụng trong chiến tranh thế giới thứ nhất. Phản ứng tổng hợp phosgen như sau: CO + Cl2 ![]() COCl2
COCl2
Biểu thức tốc độ phản ứng có dạng: ![]() . Tốc độ phản ứng thay đổi như nào nếu tăng nồng độ CO lên 2 lần.
. Tốc độ phản ứng thay đổi như nào nếu tăng nồng độ CO lên 2 lần.
Một phản ứng ở 45 ℃ có tốc độ là 0,068 mol/(L.min). Hỏi phải giảm xuống nhiệt độ bao nhiêu để tốc độ phản ứng là 0,017 mol/(L.min). Giả sử, trong khoảng nhiệt độ thí nghiệm, hệ số nhiệt độ Van’t Hoff của phản ứng bằng 2.

