20 câu trắc nghiệm Hóa 12 Cánh diều Bài 11: Nguồn điện hóa học (Đúng sai - Trả lời ngắn) có đáp án
20 câu hỏi
Mối liên hệ giữa dạng oxi hoá và dạng khử của kim loại M được biểu diễn ở dạng quá trình khử là
M→Mn++ne.
Mn++ne→M.
Mn+ →M+ne.
M+ne→Mn+.
Cho các cặp oxi hoá-khử của các kim loại và thế điện cực chuẩn tương ứng:
Cặp oxi hoá-khử | Li+/Li | Mg2+/Mg | Zn2+/Zn | Ag+/Ag |
Thế điện cực chuẩn, V | -3,040 | -2,356 | -0,762 | +0,799 |
Trong số các kim loại trên, kim loại có tính khử mạnh nhất là
Mg.
Zn.
Ag.
Li.
Trong pin điện hoá Zn-Cu, phản ứng hoá học xảy ra giữa hai dạng nào của các cặp oxi hoá-khử tương ứng?
Zn và Cu2+.
Zn và Cu.
Zn2+vàCu2+.
Zn và Cu2+.
Trong quá trình hoạt động của pin điện Zn-Cu, dòng electron di chuyển từ
cực kẽm sang cực đồng.
cực bên phải sang cực bên trái.
cathode sang anode.
cực dương sang cực âm.
Trong quá trình hoạt động của pin điện Ni-Cu, quá trình xảy ra ở anode là
Ni→Ni2++2e.
Cu→Cu2++2e.
Cu2++2e→Cu.
Ni2++2e→Ni.
Trong quá trình hoạt động của pin điện Cu-Ag, điện cực đồng
là điện cực dương.
là cathode.
là điện cực bị giảm dần khối lượng.
là nơi xảyra quá trình khử.
Trong quá trình hoạt động của pin điện hoá Zn-Cu, nhận định nào sau đây không đúng về vai trò của cầu muối?
Ngăn cách hai dung dịch chất điện li.
Chodòngelectronchạyqua.
Trunghoàđiệnởmỗidungdịchđiệnli.
Đóng kín mạch điện.
Sức điện động chuẩn của pin điện hoá H2–Cu (gồm hai điện cực ứng với hai cặp oxi hoá – khử là 2H+/H2 và Cu2+/Cu) đo được bằng vôn kế có điện trở vô cùng lớn là 0,340V. Từ đó, xác định được thế điện cực chuẩn của cặp Cu2+/ Cu là
-0,340V.
0,000V.
0,680 V.
+0,340 V.
Phản ứng hoá học xảy ratrong pin điện hoá Sn-Cu:
\[Sn + C{u^{2 + }} \to \;\;S{n^{2 + }} + Cu\]
Trong quá trình hoạt động của pin điện hoá,nhận định nào sau đây là đúng?
Khối lượng của điện cực Sn tăng.
Nồng độ Sn2+ trong dung dịch tăng.
Khối lượng của điện cực Cu giảm.
Nồng độ Cu2+ trong dung dịch tăng.
Một pin điện hoá có điện cực Zn nhúng trong dung dịch ZnSO4 và điện cực Cu nhúng trong dung dịch CuSO4. Sau một thời gian pin đó phóng điện thì
khối lượng điện cực Zn giảm còn khối lượng điện cực Cu tăng.
khối lượng điện cực Zn tăng còn khối lượng điện cực Cu giảm.
khối lượng cả hai điện cực Zn và Cu đều tăng.
khối lượng cả hai điện cực Zn và Cu đều giảm.
Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai. (Đ – S)
Trong quá trình một pin Galvani đang hoạt động.
a) Năng lượng được chuyển đổi từ hoá năng thành điện năng.
b) Xảy ra phản ứng oxi hoá- khử tự diễn biến.
c) Quá trình oxi hoá và quá trình khử xảy ra riêng biệt ở hai điện cực.
d) Sức điện động của pin không thay đổi theo thời gian.
Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai. (Đ – S)
Xét pin Galvani tạo bởi hai điện cực kim loại:
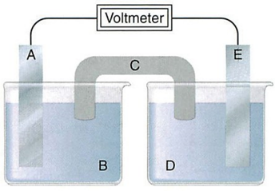
a) A là anode, E là cathode, C là cầu muối.
b) Nếu Alà Zn thì B phải là ZnSO4.
c) Nếu C chứa KNO3 thì ion K+ được chuyển từ C vào D.
d) Chiều dòng điện ở mạch ngoài từ A sang E.
Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai. (Đ – S)
Cho pin Galvani Zn-Cu hoạt động với phương trình hóa học sau:
a. Điện cực đồng là cực dương.
b. Khi pin hoạt động thì khối lượng điện cực đồng giảm.
c. Sức điện động chuẩn của pin được tính bằng công thức \[{\rm{E}}_{{\rm{pin}}}^{\rm{o}} = {\rm{E}}_{{\rm{C}}{{\rm{u}}^{{\rm{2 + }}}}{\rm{/Cu}}}^{\rm{o}} - {\rm{E}}_{{\rm{Z}}{{\rm{n}}^{{\rm{2 + }}}}{\rm{/Zn}}}^{\rm{o}}.\]
d. Sức điện động chuẩn của pin là 1,34V. Sử dụng pin này để thắp sáng một bóng đèn nhỏ với cường độ dòng điện chạy qua là I = 0,02A. Cho biết \({\rm{Q = n}}{\rm{.F = I}}{\rm{.t}}{\rm{,}}\) trong đó: Q là điện lượng, n là số mol electron đi qua dây dẫn, \({\rm{I}}\) là cường độ dòng điện (A), t là thời gian (giây), F là hằng số Faraday (F = 96500 C.mol-1). Nếu điện cực kẽm hao mòn 0,1 mol do pin phóng điện thì thời gian tối đa mà pin thắp sáng được bóng đèn là 268 giờ. (Kết quả làm tròn đến hàng đơn vị)
Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai. (Đ – S)
Pin Galvani Zn − Cu gồm điện cực kẽm và điện cực đồng được nối với nhau bởi cầu muối (thường chứa dung dịch KCl bão hòa).
a. Khi hoạt động, điện cực Zn bị tan đi.
b. Tại cực dương (cathode) xảy ra sự oxi hóa Zn.
c. Dòng electron di chuyển từ cực Zn sang cực Cu.
d. Khối lượng cực Cu tăng lên so với trước khi hoạt động.
Câu trắc nghiệm yêu cầu trả lời ngắn
Thiết lập pin điện hóa ở điều kiện chuẩn gồm hai điện cực tạo bởi các cặp oxi hóa – khử Ni2+/Ni (\(E_{N{i^{2 + }}/Ni}^0 = - 0,257V\)) và Cd2+/Cd (\(E_{C{d^{2 + }}/Cd}^0 = - 0,403V\)). Sức điện động chuẩn của pin điện hoá trên là bao nhiêu volt?
Câu trắc nghiệm yêu cầu trả lời ngắn
Lắp ráp pin điện hoá Sn - Cu ở điều kiện chuẩn. Cho biết các giá trị thế điện cực chuẩn: \(E_{S{n^{2 + }}/Sn}^0 = - 0,137V\)và \(E_{C{u^{2 + }}/Cu}^0 = + 0,340V\). Sức điện động của pin điện hóa trên là bao nhiêu vôn? (Làm tròn kết quả đến phần trăm).
Câu trắc nghiệm yêu cầu trả lời ngắn
Hai cặp oxi hoá - khử Ni2+/Ni và Cd2+/Cd tạo thành pin có sức điện độngchuẩn là 0,146 V. Phản ứng xảy ra trong pin:
Cd + Ni2+⟶Cd2+ + Ni
Thế điện cực chuẩn của cặp Cd2+/Cd có giá trị là bao nhiêu vôn? (Làm tròn kết quả đến phần trăm)
Cho biết: ở trạng thái chuẩn, pin Ni - Pb có sức điện động 0,131 V;\[{E^0}_{P{b^{2 + }}/Pb} = - 0,126V\]
Câu trắc nghiệm yêu cầu trả lời ngắn
Cho pin điện hóa Zn2+/Zn và Cu2+/ Cu. Cho \[E_{C{u^{2 + }}/Cu}^o = 0,34V\] và \(E_{Z{n^{2 + }}/Zn}^o = - 0,76V\). Sức điện động chuẩn của pin Zn – Cu là bao nhiêu volt ?
Câu trắc nghiệm yêu cầu trả lời ngắn
Sức điện động chuẩn của pin Cu2+/ Cu và Ag+/ Ag là \[{\rm{E}}_{{\rm{pin}}}^o\]= 0,46V; Biết \[{\rm{E}}_{{\rm{C}}{{\rm{u}}^{{\rm{2 + }}}}{\rm{/Cu}}}^o{\rm{ = 0}}{\rm{,34V}}\]. Thế điện cực chuẩn của cặp oxi hóa – khử Ag+/ Ag là bao nhiêu volt?
Tổng số phản ứng hóa học xảy ra khi lần lượt cho Fe, Ag, Zn, Al, Au vào dung dịch CuSO4 là bao nhiêu?

