15 câu trắc nghiệm Hóa 12 Kết nối tri thức Bài 30. Ôn tập chương 8 có đáp án
15 câu hỏi
Phần I. Câu trắc nghiệm nhiều phương án lựa chọn
Liên kết giữa nguyên tử trung tâm và phối tử trong phức chất là liên kết
cho − nhận.
cộng hóa trị phân cực.
ion.
cộng hóa trị không phân cực.
Phối tử trong phức chất [Ni(CO)4] là
Ni.
C.
O.
CO.
Cấu hình e của Ni2+ là (biết Ni có Z = 28)
1s2s22p63s23p63d84s2
1s2s22p63s23p63d8
1s2s22p63s23p63d64s2
1s22s22p63s23p63d74s1
Số oxi hóa của Cr trong hợp chất K2CrO4 là
+2.
+4.
+6.
+8.
Khi nhỏ từ từ đến dư dung dịch NaOH vào dung dịch CrCl3. Ban đầu xuất hiện kết tủa màu xanh lục (1). Sau đó kết tủa tan tạo thành dung dịch màu xanh lá cây (2). Hiện tượng cho thấy phức chất tạo thành là hiện tượng nào?
Hiện tượng (1).
Hiện tượng (2).
Cả hiện tượng (1) và hiện tượng (2).
Không có hiện tượng nào cho thấy sự tạo thành phức chất.
Cho phức chất có dạng hình học như sau:
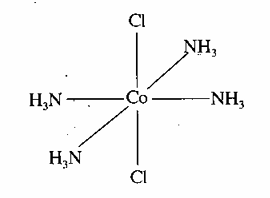
Dạng hình học của phức chất trên là
vuông phẳng.
tứ diện.
bát diện.
lưỡng tháp tam giác.
Nguyên tử trung tâm trong phức chất Na2[Zn(OH)4] là
Na+.
Zn2+.
O2−.
OH−.
Số oxi hóa của Cr trong phức [Cr(OH)6]3− là
A. +3.
+4.
+5.
+6.
Kim loại có độ dẫn điện cao nhất trong 4 kim loại: Cu, Li, Ca, Na là
Li.
Ca.
Na.
Cu.
Xác định A trong phương trình sau:
[Cr(H2O)3(OH)3](aq) + 3OH−(aq) → A(aq) + 3H2O(l)
[Cr(OH)6]3−
[Cr(OH)6]2−
[Cr(H2O)6]3−
[Cr(H2O)6]2−
Phần II. Câu trắc nghiệm đúng sai. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai. (Đ – S)
Nhỏ vài giọt dung dịch HCl đặc vào ống nghiệm đựng dung dịch CuSO4 loãng.
a. Dung dịch từ màu xanh chuyển sang màu vàng.
b. Phức chất [Cu(H2O)4]2+ được tạo thành.
c. Các phối tử H2O trong phức chất [Cu(H2O)4]2+ đã bị thay thế bởi phối tử SO42−.
d. Phức chất tạo thành có dạng bát diện.
Để xác định nồng dộ iron (II) sulfate trong dung dịch X người ta sử dụng phương pháp chuẩn độ với dung dịch thuốc tím trong môi trường acid.
a. Dung dịch thu được sau phản ứng có màu hồng tím.
b. Có sự xuất hiện của MnO2 màu đen.
c. Có khí SO2 tạo thành trong quá trình làm thí nghiệm.
d. Cứ 1 mol KMnO4 tham gia phản ứng sẽ tác dụng với 5 mol FeSO4.
Phần III: Câu hỏi trắc nghiệm yêu cầu trả lời ngắn.
Theo QCVN 01−1:2018/BYT, hàm lượng sắt tối đa cho phép trong nước sinh hoạt là 0,3mg/L. Một mẫu nước có hàm lượng sắt cao gấp 28 lần ngưỡng cho phép, giả thiết sắt trong mẫu nước tồn tại ở dạng Fe2(SO4)3 và FeSO4 với tỉ lệ mol tương ứng là 1 : 8. Quá trình tách loại sắt trong 10m3 mẫu nước trên được thực hiện bằng cách sử dụng m gam vôi tôi (vừa đủ) để tăng pH, sau đó sục không khí:
Fe2(SO4)3 + 3Ca(OH)2 → 2Fe(OH)3 + 3CaSO4 (1)
4FeSO4 + 4Ca(OH)2 + O2 + 2H2O → 4Fe(OH)3 + 4CaSO4 (2)
Giả thiết vôi tôi chỉ chứa Ca(OH)2. Giá trị của m là bao nhiêu gam? (Làm tròn kết quả đến hàng phần mười).
Xét phản ứng sau:
[Cr(H2O)6]3+(aq) + 3OH−(aq) → [Cr(H2O)3(OH)3]↓(s) + 3H2O(l)
Hãy cho biết trong phản ứng trên có bao nhiêu phối tử H2O bị thay thế bởi phối tử OH−.
Trong phòng thí nghiệm, nồng độ iron(II) sulfate có thể được xác định bằng phương pháp chuẩn độ theo phương trình hóa học sau:
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
Chuẩn độ 10 mL dung dịch FeSO4 a M cần 50 mL dung dịch KMnO4 0,02 M. Tìm giá trị của a.

