45 câu hỏi
Hằng số cân bằng KC của một phản ứng thuận nghịch phụ thuộc vào yếu tố nào sau đây?
B. Nhiệt độ.
C. Áp suất.
D. Chất xúc tác.
Nồng độ.
Hằng số cân bằng KC của một phản ứng thuận nghịch phụ thuộc vào yếu tố nào sau đây?
Nồng độ.
Nhiệt độ.
Áp suất.
Chất xúc tác.
Hằng số cân bằng KC của một phản ứng thuận nghịch phụ thuộc vào yếu tố nào sau đây?
Nồng độ.
Nhiệt độ.
Áp suất.
Chất xúc tác.
Phát biểu nào sau đây về một phản ứng thuận nghịch tại trạng thái cân bằng là không đúng?
Tốc độ của phản ứng thuận bằng tốc độ của phản ứng nghịch.
Nồng độ của tất cả các chất trong hỗn hợp phản ứng là không đổi.
Nồng độ mol của chất phản ứng luôn bằng nồng độ mol của chất sản phẩm phản ứng.
Phản ứng thuận và phản ứng nghịch vẫn diễn ra.
Phát biểu nào sau đây về một phản ứng thuận nghịch tại trạng thái cân bằng là không đúng?
Tốc độ của phản ứng thuận bằng tốc độ của phản ứng nghịch.
Nồng độ của tất cả các chất trong hỗn hợp phản ứng là không đổi.
Nồng độ mol của chất phản ứng luôn bằng nồng độ mol của chất sản phẩm phản ứng.
Phản ứng thuận và phản ứng nghịch vẫn diễn ra.
Phát biểu nào sau đây về một phản ứng thuận nghịch tại trạng thái cân bằng là không đúng?
Tốc độ của phản ứng thuận bằng tốc độ của phản ứng nghịch.
Nồng độ của tất cả các chất trong hỗn hợp phản ứng là không đổi.
Nồng độ mol của chất phản ứng luôn bằng nồng độ mol của chất sản phẩm phản ứng.
Phản ứng thuận và phản ứng nghịch vẫn diễn ra.
Cho phản ứng thuận nghịch: 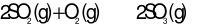 . Hằng số cân bằng của phản ứng trên là
. Hằng số cân bằng của phản ứng trên là
A.  .
.
B.  .
.
C.  .
.

Cho phản ứng thuận nghịch: . Hằng số cân bằng của phản ứng trên là
\({K_C} = \frac{{{{[S{O_3}]}^2}}}{{{{[S{O_2}]}^2}.[{O_2}]}}\).
\({K_C} = \frac{{[S{O_3}]}}{{[S{O_2}].[{O_2}]}}\).
\({K_C} = \frac{{{{[S{O_2}]}^2}.[{O_2}]}}{{{{[S{O_3}]}^2}}}\).
\({K_C} = \frac{{[S{O_2}].[{O_2}]}}{{[S{O_3}]}}.\)
Cho phản ứng thuận nghịch: . Hằng số cân bằng của phản ứng trên là
.
.
.
Xét cân bằng: N2O4(g)  2NO2 (g) ở
2NO2 (g) ở 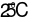 . Khi chuyển dịch sang một trạng thái cân bằng mới nếu nồng độ của N2O4 tăng lên 9 lần thì nồng độ của NO2:
. Khi chuyển dịch sang một trạng thái cân bằng mới nếu nồng độ của N2O4 tăng lên 9 lần thì nồng độ của NO2:
tăng 9 lần.
tăng 3 lần.
tăng 4,5 lần.
giảm 3 lần.
Xét cân bằng: N2O4(g) 2NO2 (g) ở \[{25^0}C\]. Khi chuyển dịch sang một trạng thái cân bằng mới nếu nồng độ của N2O4 tăng lên 9 lần thì nồng độ của NO2:
tăng 9 lần.
tăng 3 lần.
tăng 4,5 lần.
giảm 3 lần.
Xét cân bằng: N2O4(g) 2NO2 (g) ở . Khi chuyển dịch sang một trạng thái cân bằng mới nếu nồng độ của N2O4 tăng lên 9 lần thì nồng độ của NO2:
tăng 9 lần.
tăng 3 lần.
tăng 4,5 lần.
giảm 3 lần.
Trộn 2 mol khí NO và một lượng chưa xác định khí O2 vào trong một bình kín có dung tích 1 lít ở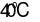 . Biết: 2NO(g) + O2 (g)
. Biết: 2NO(g) + O2 (g)  2 NO2 (g)
2 NO2 (g)
Khi phản ứng đạt đến trạng thái cân bằng, ta được hỗn hợp khí có 0,00156 mol O2 và 0,5 mol NO2. Hằng số cân bằng KC lúc này có giá trị là
4,42.
40,1.
71,2.
214.
Trộn 2 mol khí NO và một lượng chưa xác định khí O2 vào trong một bình kín có dung tích 1 lít ở\[{40^o}C\]. Biết: 2NO(g) + O2 (g) 2 NO2 (g)
Khi phản ứng đạt đến trạng thái cân bằng, ta được hỗn hợp khí có 0,00156 mol O2 và 0,5 mol NO2. Hằng số cân bằng KC lúc này có giá trị là
4,42.
40,1.
71,2.
214.
Trộn 2 mol khí NO và một lượng chưa xác định khí O2 vào trong một bình kín có dung tích 1 lít ở. Biết: 2NO(g) + O2 (g) 2 NO2 (g)
Khi phản ứng đạt đến trạng thái cân bằng, ta được hỗn hợp khí có 0,00156 mol O2 và 0,5 mol NO2. Hằng số cân bằng KC lúc này có giá trị là
4,42.
40,1.
71,2.
214.
Cho cân bằng hoá học: H2 (g) + I2 (g)  2HI (g); ∆H > 0. Cân bằng không bị chuyển dịch khi:
2HI (g); ∆H > 0. Cân bằng không bị chuyển dịch khi:
tăng nhiệt độ của hệ.
giảm nồng độ HI.
giảm áp suất chung của hệ.
tăng nồng độ H2.
Cho cân bằng hoá học: H2 (g) + I2 (g) 2HI (g); ∆H > 0. Cân bằng không bị chuyển dịch khi:
tăng nhiệt độ của hệ.
giảm nồng độ HI.
giảm áp suất chung của hệ.
tăng nồng độ H2.
Cho cân bằng hoá học: H2 (g) + I2 (g) 2HI (g); ∆H > 0. Cân bằng không bị chuyển dịch khi:
tăng nhiệt độ của hệ.
giảm nồng độ HI.
giảm áp suất chung của hệ.
tăng nồng độ H2.
Cho phản ứng: N2 (g) + 3H2 (g)  2NH3 (g). Biết rằng phản ứng thuận là phản ứng toả nhiệt, cân bằng hoá học không bị chuyển dịch khi nào?
2NH3 (g). Biết rằng phản ứng thuận là phản ứng toả nhiệt, cân bằng hoá học không bị chuyển dịch khi nào?
Thay đổi áp suất của hệ.
Thay đổi nhiệt độ của hệ.
Thay đổi nồng độ N2.
Thêm chất xúc tác Fe.
Cho phản ứng: N2 (g) + 3H2 (g) 2NH3 (g). Biết rằng phản ứng thuận là phản ứng toả nhiệt, cân bằng hoá học không bị chuyển dịch khi nào?
Thay đổi áp suất của hệ.
Thay đổi nhiệt độ của hệ.
Thay đổi nồng độ N2.
Thêm chất xúc tác Fe.
Cho phản ứng: N2 (g) + 3H2 (g) 2NH3 (g). Biết rằng phản ứng thuận là phản ứng toả nhiệt, cân bằng hoá học không bị chuyển dịch khi nào?
Thay đổi áp suất của hệ.
Thay đổi nhiệt độ của hệ.
Thay đổi nồng độ N2.
Thêm chất xúc tác Fe.
Cho phản ứng:
2NO2 (g) (màu nâu đỏ)  N2O4 (g) (không màu)
N2O4 (g) (không màu) 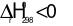 .
.
Nếu nhúng bình phản ứng vào nước đá thì:
Giữ nguyên màu như ban đầu.
Màu nâu đậm dần.
Màu nâu nhạt dần.
Chuyển sang màu xanh.
Cho phản ứng:
2NO2 (g) (màu nâu đỏ) N2O4 (g) (không màu) \({\Delta _r}H_{298}^0 < 0\).
Nếu nhúng bình phản ứng vào nước đá thì:
Giữ nguyên màu như ban đầu.
Màu nâu đậm dần.
Màu nâu nhạt dần.
Chuyển sang màu xanh.
Cho phản ứng:
2NO2 (g) (màu nâu đỏ) N2O4 (g) (không màu) .
Nếu nhúng bình phản ứng vào nước đá thì:
Giữ nguyên màu như ban đầu.
Màu nâu đậm dần.
Màu nâu nhạt dần.
Chuyển sang màu xanh.
Phản ứng tổng hợp ammonia là: N2(g) + 3H2(g)  2NH3(g);
2NH3(g); 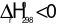 . Yếu tố không giúp tăng hiệu suất tổng hợp ammonia là
. Yếu tố không giúp tăng hiệu suất tổng hợp ammonia là
tăng nhiệt độ.
lấy ammonia ra khỏi hỗn hợp phản ứng.
tăng áp suất.
bổ sung thêm khí nitrogen vào hỗn hợp phản ứng.
Phản ứng tổng hợp ammonia là: N2(g) + 3H2(g) 2NH3(g); \({\Delta _r}H_{298}^0 < 0\). Yếu tố không giúp tăng hiệu suất tổng hợp ammonia là
tăng nhiệt độ.
lấy ammonia ra khỏi hỗn hợp phản ứng.
tăng áp suất.
bổ sung thêm khí nitrogen vào hỗn hợp phản ứng.
Phản ứng tổng hợp ammonia là: N2(g) + 3H2(g) 2NH3(g); . Yếu tố không giúp tăng hiệu suất tổng hợp ammonia là
tăng nhiệt độ.
lấy ammonia ra khỏi hỗn hợp phản ứng.
tăng áp suất.
bổ sung thêm khí nitrogen vào hỗn hợp phản ứng.
Cho phản ứng sau đây ở trạng thái cân bằng: A(g) + B(g)  C(g) + D(g).
C(g) + D(g).
Nếu tách khí D ra khỏi môi trường phản ứng, thì:
Cân bằng hoá học chuyển dịch theo chiều thuận.
Cân bằng hoá học chuyển dịch theo chiều nghịch.
Tốc độ phản ứng thuận và tốc độ của phản ứng nghịch tăng như nhau.
Không gây ra sự chuyển dịch cân bằng hoá học.
Cho phản ứng sau đây ở trạng thái cân bằng: A(g) + B(g) C(g) + D(g).
Nếu tách khí D ra khỏi môi trường phản ứng, thì:
Cân bằng hoá học chuyển dịch theo chiều thuận.
Cân bằng hoá học chuyển dịch theo chiều nghịch.
Tốc độ phản ứng thuận và tốc độ của phản ứng nghịch tăng như nhau.
Không gây ra sự chuyển dịch cân bằng hoá học.
Cho phản ứng sau đây ở trạng thái cân bằng: A(g) + B(g) C(g) + D(g).
Nếu tách khí D ra khỏi môi trường phản ứng, thì:
Cân bằng hoá học chuyển dịch theo chiều thuận.
Cân bằng hoá học chuyển dịch theo chiều nghịch.
Tốc độ phản ứng thuận và tốc độ của phản ứng nghịch tăng như nhau.
Không gây ra sự chuyển dịch cân bằng hoá học.
Trong phản ứng tổng hợp ammonia: N2(g) + 3H2(g)  2NH3(g); ∆rH < 0.
2NH3(g); ∆rH < 0.
Sẽ thu được nhiều khí NH3 nhất nếu:
>
Giảm nhiệt độ và áp suất.
Tăng nhiệt độ và áp suất.
Tăng nhiệt độ và giảm áp suất.
Giảm nhiệt độ và tăng áp suất.
Trong phản ứng tổng hợp ammonia: N2(g) + 3H2(g) 2NH3(g); ∆rH < 0.
Sẽ thu được nhiều khí NH3 nhất nếu:
>
Giảm nhiệt độ và áp suất.
Tăng nhiệt độ và áp suất.
Tăng nhiệt độ và giảm áp suất.
Giảm nhiệt độ và tăng áp suất.
Trong phản ứng tổng hợp ammonia: N2(g) + 3H2(g) 2NH3(g); ∆rH < 0.
Sẽ thu được nhiều khí NH3 nhất nếu:
Giảm nhiệt độ và áp suất.
Tăng nhiệt độ và áp suất.
Tăng nhiệt độ và giảm áp suất.
Giảm nhiệt độ và tăng áp suất.
Cho cân bằng: 2NaHCO3(s)  Na2CO3(s) + CO2(g) + H2O(g); ∆rH < 0
Na2CO3(s) + CO2(g) + H2O(g); ∆rH < 0
Để cân bằng dịch chuyển theo chiều thuận, cách tốt nhất là
>
tăng nhiệt độ.
giảm nhiệt độ.
tăng áp suất.
tăng nhiệt độ, tăng áp suất.
Cho cân bằng: 2NaHCO3(s) Na2CO3(s) + CO2(g) + H2O(g); ∆rH < 0
Để cân bằng dịch chuyển theo chiều thuận, cách tốt nhất là
>
tăng nhiệt độ.
giảm nhiệt độ.
tăng áp suất.
tăng nhiệt độ, tăng áp suất.
Cho cân bằng: 2NaHCO3(s) Na2CO3(s) + CO2(g) + H2O(g); ∆rH < 0
Để cân bằng dịch chuyển theo chiều thuận, cách tốt nhất là
tăng nhiệt độ.
giảm nhiệt độ.
tăng áp suất.
tăng nhiệt độ, tăng áp suất.
Ở nhiệt độ không đổi, hệ cân bằng nào sẽ dịch chuyển về bên phải nếu tăng áp suất?
S(s) + O2(g)  SO2(g).
SO2(g).
2CO2(g)  2CO(g) + O2(g).
2CO(g) + O2(g).
2NO(g)  N2(g) + O2(g).
N2(g) + O2(g).
2CO(g)  CO2(g) + C(s).
CO2(g) + C(s).
Ở nhiệt độ không đổi, hệ cân bằng nào sẽ dịch chuyển về bên phải nếu tăng áp suất?
S(s) + O2(g) SO2(g).
2CO2(g) 2CO(g) + O2(g).
2NO(g) N2(g) + O2(g).
2CO(g) CO2(g) + C(s).
Ở nhiệt độ không đổi, hệ cân bằng nào sẽ dịch chuyển về bên phải nếu tăng áp suất?
S(s) + O2(g) SO2(g).
2CO2(g) 2CO(g) + O2(g).
2NO(g) N2(g) + O2(g).
2CO(g) CO2(g) + C(s).
Cho cân bằng hóa học: 2SO2(g) + O2(g)  2SO3(g); phản ứng thuận là phản ứng tỏa nhiệt. Phát biểu đúng là
2SO3(g); phản ứng thuận là phản ứng tỏa nhiệt. Phát biểu đúng là
Cân bằng chuyển dịch theo chiều thuận khi tăng nhiệt độ.
Cân bằng chuyển dịch theo chiều nghịch khi giảm nồng độ O2.
Cân bằng chuyển dịch theo chiều thuận khi giảm áp suất hệ phản ứng.
Cân bằng chuyển dịch theo chiều nghịch khi giảm nồng độ SO3.
Cho cân bằng hóa học: 2SO2(g) + O2(g) 2SO3(g); phản ứng thuận là phản ứng tỏa nhiệt. Phát biểu đúng là
Cân bằng chuyển dịch theo chiều thuận khi tăng nhiệt độ.
Cân bằng chuyển dịch theo chiều nghịch khi giảm nồng độ O2.
Cân bằng chuyển dịch theo chiều thuận khi giảm áp suất hệ phản ứng.
Cân bằng chuyển dịch theo chiều nghịch khi giảm nồng độ SO3.
Cho cân bằng hóa học: 2SO2(g) + O2(g) 2SO3(g); phản ứng thuận là phản ứng tỏa nhiệt. Phát biểu đúng là
Cân bằng chuyển dịch theo chiều thuận khi tăng nhiệt độ.
Cân bằng chuyển dịch theo chiều nghịch khi giảm nồng độ O2.
Cân bằng chuyển dịch theo chiều thuận khi giảm áp suất hệ phản ứng.
Cân bằng chuyển dịch theo chiều nghịch khi giảm nồng độ SO3.
Cho phản ứng: Fe2O3 (s) + 3CO (g)  2Fe (s) + 3CO2 (g).
2Fe (s) + 3CO2 (g).
Khi tăng áp suất chung của hệ phản ứng thì
cân bằng chuyển dịch theo chiều thuận.
cân bằng không bị chuyển dịch.
cân bằng chuyển dịch theo chiều nghịch.
phản ứng dừng lại.
Cho phản ứng: Fe2O3 (s) + 3CO (g) 2Fe (s) + 3CO2 (g).
Khi tăng áp suất chung của hệ phản ứng thì
cân bằng chuyển dịch theo chiều thuận.
cân bằng không bị chuyển dịch.
cân bằng chuyển dịch theo chiều nghịch.
phản ứng dừng lại.
Cho phản ứng: Fe2O3 (s) + 3CO (g) 2Fe (s) + 3CO2 (g).
Khi tăng áp suất chung của hệ phản ứng thì
cân bằng chuyển dịch theo chiều thuận.
cân bằng không bị chuyển dịch.
cân bằng chuyển dịch theo chiều nghịch.
phản ứng dừng lại.
